이번에는 화학 구조와 공식에 대해 배운 내용을 사용하여 원자와 분자 사이의 질량 관계를 탐구합니다.
이러한 상관 관계는 화합물의 조성과 조성 변화의 패턴을 설명하는 데 도움이 됩니다.
원자의 질량은 포함된 전자, 양성자 및 중성자의 수에 따라 달라집니다.
원자 질량을 아는 것은 실험을 수행하는 데 중요합니다.
그러나 원자는 매우 작은 입자로 구성되어 있습니다.
육안으로 볼 수 있는 가장 작은 먼지 입자도 1×10¹⁶ 원자로 구성되어 있습니다.
분명히 원자의 무게는 측정할 수 없지만 실험을 통해 한 원자의 질량과 다른 원자의 질량을 비교함으로써 상대적으로 측정할 수 있습니다.
첫 번째 단계는 기준 물질로 사용할 수 있도록 주어진 원소의 원자 질량에 대한 수치를 결정하는 것입니다.
국제 협약으로, 원자 질량 (자주 원자량일명) 이란 원자 질량 단위(amu) 원자의 질량을 의미하고, 원자 질량 단위는 탄소-12 원자 질량의 정확히 1/12인 질량으로 정의됩니다.
탄소-12는 양성자 6개와 중성자 6개를 가진 탄소의 동위원소이다.
탄소-12를 12 amu로 결정하는 것은 다른 원소의 원자 질량을 측정할 수 있는 기준을 제공합니다.
예를 들어, 실험에 따르면 평균적으로 수소 원자는 기준 물질의 탄소-12 원자 질량의 8.400%를 차지합니다.
따라서 탄소-12 원자의 질량이 정확히 12amu이면 수소의 원자 질량은 0.082 × 12.00amu 또는 1.008amu입니다.
이 계산에 따르면 산소의 원자량은 16.00amu이고 철의 원자량은 55.85amu입니다.
따라서 철 원자의 정확한 평균 질량을 모르더라도 수소 원자의 약 56배의 질량을 가지고 있다는 것을 알 수 있습니다.
평균 원자 질량
여기서 탄소의 원자량을 보면 값이 12.99 amu가 아니라 12.01 amu로 표시됩니다.
이러한 차이는 탄소를 비롯한 자연계의 대부분의 원소가 2개 이상의 동위원소를 가지고 있기 때문입니다.
따라서 원소의 원자량을 측정할 때 일반적으로 자연적으로 발생하는 동위원소 혼합물의 평균 질량으로 결정해야 합니다.
예를 들어 탄소-12와 탄소-13은 자연에서 각각 98.90%와 1.10%로 발생합니다.
탄소-13의 원자량은 12.00335amu로 측정됩니다.
따라서 탄소의 평균 원자량은 다음과 같이 계산할 수 있습니다.
자연에 존재하는 탄소의 평균 원자량
= (0.9890)(12.00000amu) + (0.0110)(13.00335amu)
= 12.01am
백분율을 계산할 때 백분율을 백분율로 변환해야 합니다.
예를 들어 98.90%는 98.90/100 또는 0.9890이 됩니다.
자연계에는 탄소-13 원자보다 탄소-12 원자가 더 많기 때문에 평균 원자 질량은 13 amu보다 12 amu에 더 가깝습니다.
탄소 질량이 12.01amu라고 가정하면 이 값은 평균값이라는 점에 유의해야 합니다.
탄소 원자를 개별적으로 보면 원소의 원자 질량은 12.00000amu 또는 13.00335amu이지만 둘 다 12.01amu는 아닙니다.
많은 원소의 원자 질량은 5자리 또는 6자리 유효 숫자로 측정할 수 있습니다.
다만, 편의상 유효숫자 4자리까지 측정값을 사용하기로 한다.
단순화를 위해 원소의 원자량을 언급할 때 “평균”이라는 단어는 생략됩니다.
3.2 원소의 아보가드로 수와 몰 질량
원자 질량 단위는 원소 질량의 상대적인 척도를 제공합니다.
그러나 원자는 질량이 매우 작기 때문에 원자 질량 단위로 무게를 측정하는 저울을 고안하는 것은 불가능합니다.
실제 상황에서 우리는 엄청난 수의 원자를 포함하는 거시적 샘플을 다루고 있습니다.
따라서 특수 단위는 매우 많은 수의 원자를 나타내는 데 유용합니다.
특정 수의 물질을 표현하기 위해 단위를 사용하는 것은 새로운 아이디어가 아닙니다.
예를 들어 쌍(2), 다스(12) 및 총(12 다스, 144)은 알려진 단위입니다.
화학자들은 원자와 분자를 몰 단위로 측정합니다.
SI 시스템으로 정의 두더지 (두더지, 약어 두더지)은 정확히 12g(또는 0.012kg)의 탄소-12 동위원소에 포함된 원자의 수와 동일한 여러 기본 물질(원자, 분자 또는 기타 입자)을 포함하는 물질의 양.탄소-12 12g의 실제 원자 수는 실험적으로 결정됩니다.
이 번호 아보가드로 수 NA이 숫자는 이탈리아 과학자 Amedeo Avogadro를 기리기 위해 주어졌습니다.
현재 사용중인 번호는
없음 = 6.0221367 × 10²³
오전. 일반적인 계산에서 이 값은 6.022 × 10²³로 반올림됩니다.
연필 12개가 12를 의미하는 것처럼 1몰의 수소 원자에는 6.022 × 10²³의 H 원자가 있습니다.
1몰의 탄소-12 원자는 정확히 12그램의 질량을 갖고 6.022 × 10²³ 원자를 포함하는 것으로 밝혀졌습니다.
이 탄소-12의 질량은 몰 질량 (약자 중)라고, 물질의 기본 단위(예: 원자 또는 분자) 1몰의 질량(g 또는 kg)으로 정의탄소-12의 몰 질량(그램 단위)은 Amu 단위의 탄소 원자량과 수치적으로 같습니다.
마찬가지로 나트륨(Na)의 원자 질량은 22.99amu이고 몰 질량은 22.99g입니다.
인의 원자량은 30.97amu이고 몰 질량은 30.97g입니다.
따라서 원소의 원자 질량을 알면 몰 질량도 알 수 있습니다.
원자 질량과 몰 질량을 사용하여 탄소-12 원자의 질량을 그램 단위로 계산할 수 있습니다.
앞서 언급한 바와 같이 탄소-12 원자 1몰은 정확히 12그램이므로 다음 식으로 나타낼 수 있습니다.
탄소-12 12.00g = 탄소-12 원자 1몰
따라서 우리는 단위 요소를 다음과 같이 쓸 수 있습니다.
12.00g 탄소 12 원자
———————————
탄소 12 원자 1몰
마찬가지로 1몰의 탄소-12 원자에는 6.022 × 10²³ 원자가 있습니다.
1몰의 탄소-12 원자 = 6.022×10²³ 탄소-12 원자
단위 요소는 다음과 같습니다.
탄소 12 원자 1몰
————————————
탄소-12 원자 6.022×10²³
이제 탄소-12 원자의 질량을 다음과 같이 계산할 수 있습니다.
탄소 12 원자 1몰 12.00g 탄소 12 원자
1 탄소-12 원자 × ——————————— × ——————————— = 1.993 x 10²³ g 탄소-12
탄소-12 원자 6,022×10²³ 탄소 12 원자 1몰
이 결과를 이용하여 원자 질량 단위(amu)와 그램 단위(g) 사이의 상관관계를 얻을 수 있습니다.
각 탄소-12 원자의 질량은 정확히 12amu이므로 1amu에 해당하는 그램 수는 다음과 같습니다.
아무 1 탄소-12 원자 12시
——— = —————————— × ————————— = 6.022 × 10²³ amu/g
g 1.993 x 10⁻²³ g 1 탄소-12 원자
따라서 1g = 6.022 × 10²³ amu입니다.
따라서 다음과 같은 관계를 얻을 수 있습니다.
1am = 1.661 × 10⁻²⁴g
이 예는 아보가드로 수를 사용하여 원자 질량 단위(amu)를 그램 단위의 질량으로 또는 그 반대로 변환할 수 있음을 보여줍니다.
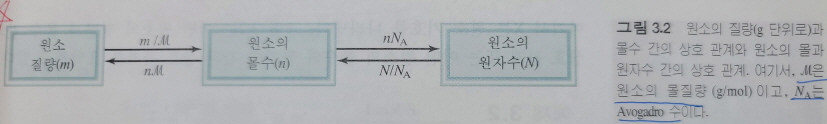
아보가드로 수와 몰 질량의 개념을 사용하여 원자의 질량과 몰수, 원자의 수와 질량 사이를 변환할 수 있으며 단일 원자의 질량도 계산할 수 있습니다.
X 1몰 X 1몰
—— 또는 ———
몰 질량 of X atom X 6.022×10²³
여기서 X는 요소 기호를 나타냅니다.
위의 그림은 원소의 질량과 몰수 또는 원소의 몰수와 원자수 사이의 관계를 요약한 것입니다.